上海南方模式生物科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
Cell Metabolism │ 蜕膜TMAO代谢失调可导致反复自发性流产
21 人阅读发布时间:2026-02-03 10:04
2026年1月8日,上海交通大学赵健元、李博、复旦大学金莉萍,上海国际和平妇幼保健院李明清共同通讯在Cell Metabolism(IF=30.9)在线发表题为Endometrial stromal cell-derived TMAO sustains decidualization to prevent recurrent spontaneous abortion的研究论文。
该研究首次揭示子宫内膜间质细胞合成的三甲胺N-氧化物(TMAO)在维持胚胎早期发育所需的“子宫内膜准备”过程中发挥决定性作用,为临床上复发性流产提供了一种潜在的治疗方法。

南模生物为该研究提供了Pgr-Cre(NM-KI-200117)子宫特异性表达Cre工具鼠
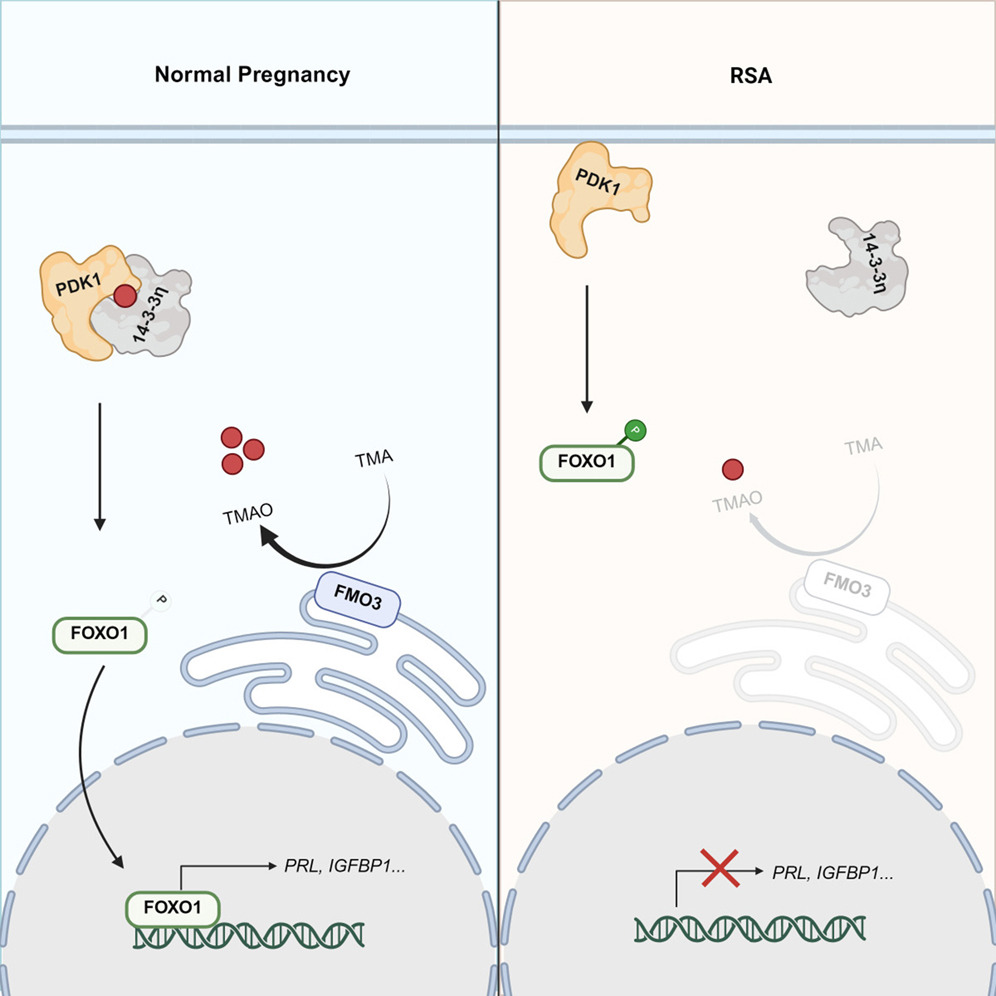
反复自发性流产(RSA)被定义为在孕早期连续流产两次或以上,影响约2%的孕妇及其伴侣,并带来经济负担以及心理创伤。在致病因素中,子宫蜕膜化异常被认为是导致RSA的重要原因。
蜕膜化是一个重塑过程,其中子宫内膜基质细胞(ESC)将成纤维细胞样细胞转化为大的多边形细胞,通常称为蜕膜基质细胞(DSC)。DSC分泌催乳素(PRL)和胰岛素样生长因子结合蛋白-1(IGFBP1),它们是蜕膜化的关键调节因子,已被广泛用作人类蜕膜化的标志。
蜕膜化涉及细胞信号网络和代谢途径的复杂重新编程。通过营养干预调整代谢动态,从而调控蜕膜化,成为了减轻RSA风险的一种干预思路。
在代谢方面,胆碱及其代谢物参与体内多种重要过程。其中,研究发现,三甲胺N-氧化物(TMAO)在怀孕期间的需求大幅增加,但其具体生理或病理功能仍不清楚。
1
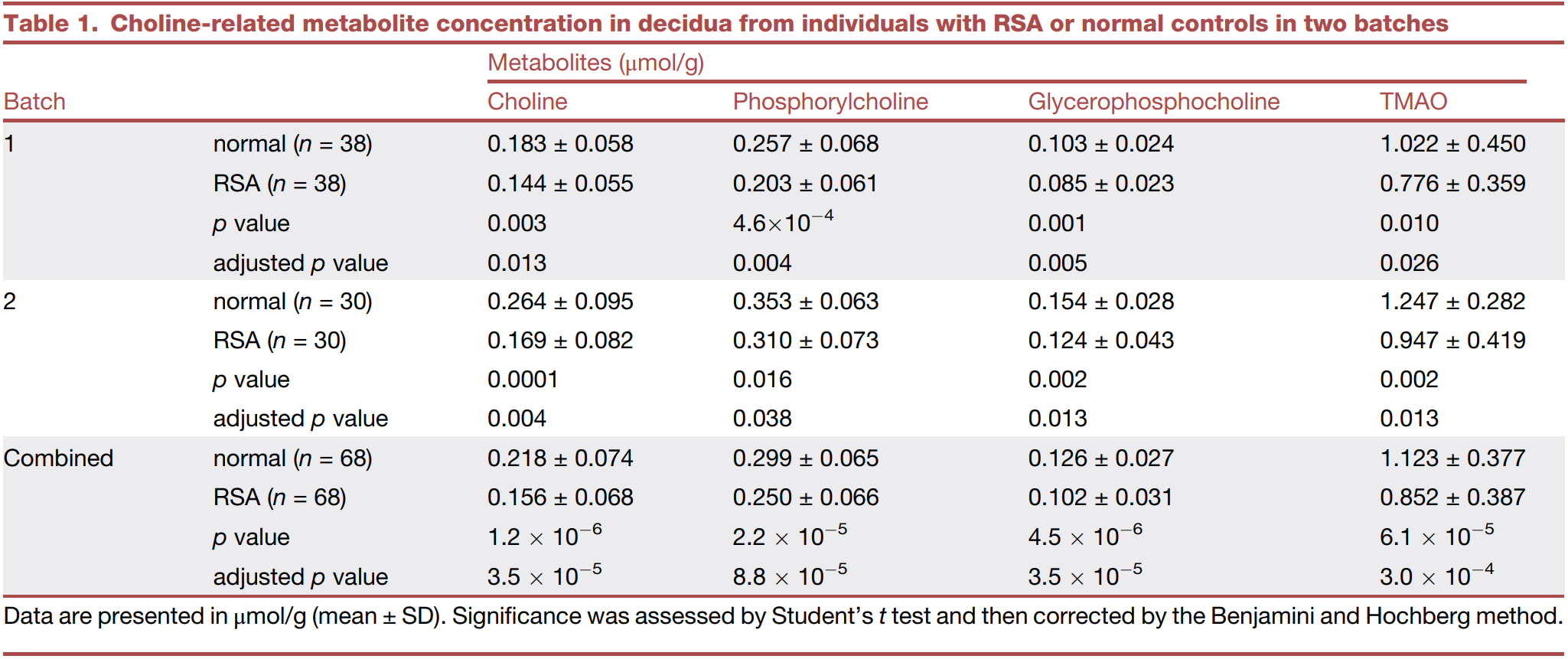
胆碱和TMAO浓度的下调与RSA相关
研究者采集了38例RSA患者和38名因非医学原因终止妊娠的临床正常妊娠个体样本,通过核磁共振的非靶向代谢组分析,观察两者的代谢差异。结果表明,在RSA病例的胎盘基底膜中,胆碱相关代谢产物,包括胆碱、磷酰胆碱、甘油磷胆和TMAO显著低于对照组,而在绒毛组织与血浆样本中进行了相关分析非发现明显差异。这表明与复发性流产相关的并非饮食诱导的代谢差异,而是胎盘基底膜中局部产生的胆碱相关代谢物丰度降低。
2
TMAO促进了蜕膜化过程
研究者从健康个体子宫内膜样本中分离出人原代胚胎干细胞(HpESCs),并通过体外诱导将ESCs分化为DESCs,其特征为胎盘基质标志物PRL和IGFBP1显著上调。
胆碱相关代谢产物中,研究者发现仅TMA和TMAO显著上调IGFBP1和PRL的表达,且TMAO和TMA均能促进HpESCs体外蜕膜化进程(图B-C)。
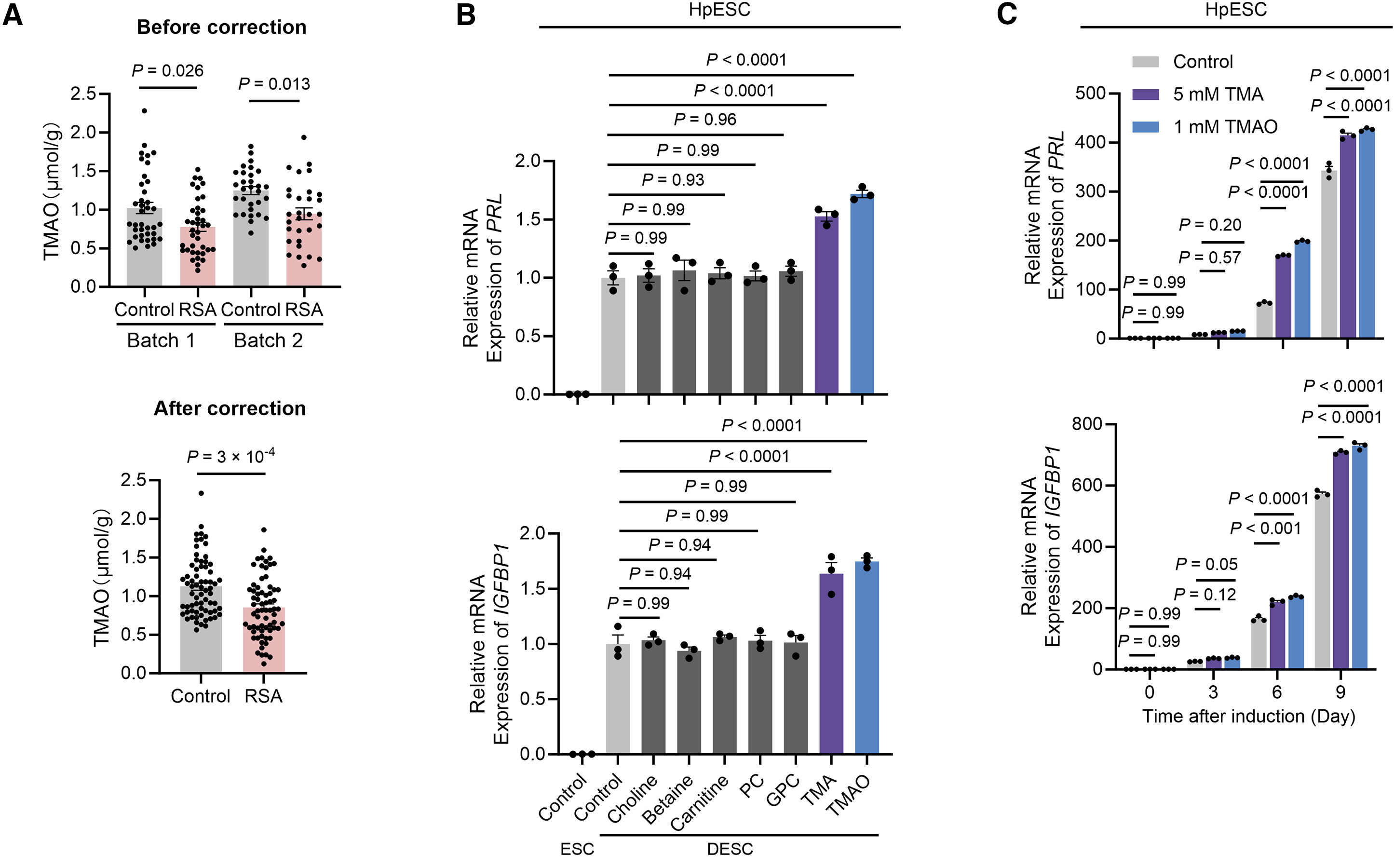
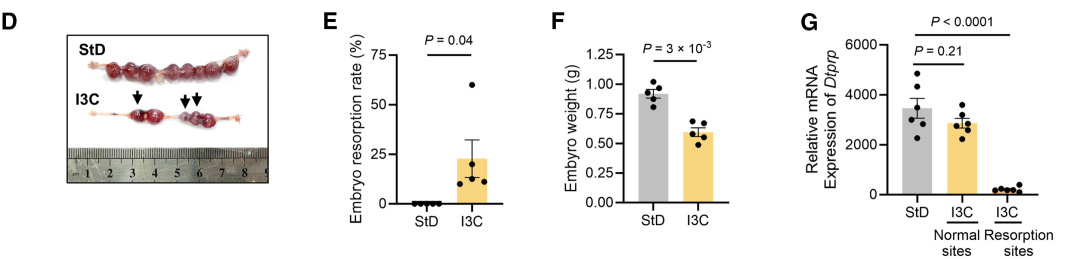
随后,研究者将FMO抑制剂I3C加入小鼠饮食中,通过抑制肝脏代谢,降低肝脏与子宫中的TMAO浓度。在妊娠第10.5天,I3C组小鼠出现明显胚胎流失倾向、胚胎体重降低以及Dtprp表达下降的蜕膜化障碍(图D-G)。
此外,标准饲料喂养小鼠的子宫TMAO浓度随妊娠天数增加而升高,并在妊娠第10.5天达到峰值,与实验组出现表型时间吻合。随后研究者采用胆碱缺乏饲料喂养以限制TMAO生成。小鼠随机分配至标准饮食组(StD)、胆碱缺乏饮食组(CDD)或补充0.5% TMAO的CDD组。在妊娠第10.5天时,与StD组相比,CDD组胚胎吸收率升高,补充TMAO后该现象得到逆转,且CDD组Dtprp表达显著降低(图H-J)。
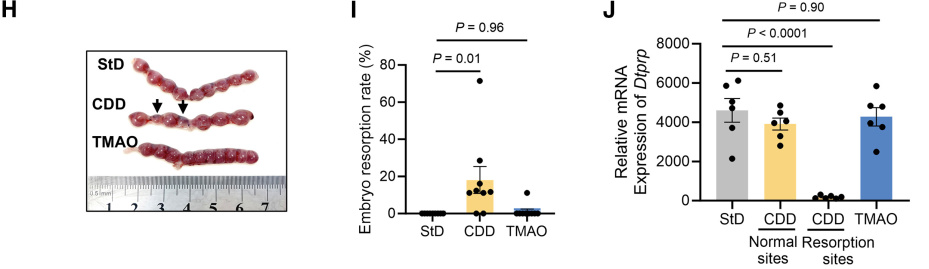
为探究TMAO在蜕膜化过程中的作用,通过在三种不同饮食中添加芝麻油诱导假性蜕膜化反应。CDD组小鼠对刺激反应减弱,导致其滋养层瘤体积小于对照组。但补充TMAO可有效挽救该表型(图K和L)。
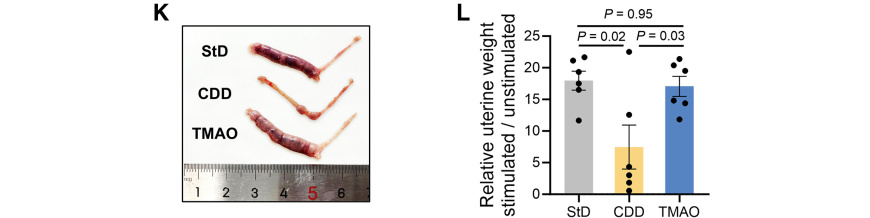
这些结果表明妊娠小鼠子宫内TMAO浓度下降会导致不良妊娠结局,妊娠第10.5天显著提高胎盘基底膜中的TMAO水平可预防流产。综上,TMAO(而非其他衍生物)在蜕膜化过程中具有关键作用。
3
妊娠期间FMO3表达量
可影响胎盘基底膜中TMAO浓度
研究者发现,人类健康个体胎盘基底膜中的TMAO浓度显著高于对应血浆样本。这表明,升高的TMAO水平可能由胎盘基底膜内的FMOs原位合成。
研究者重点关注了FMO家族酶中的TMA氧化特异性酶FMO3,并证实在人胚胎干细胞FMO3沉默显著抑制TMAO生成。
接下来,研究者检测人类妊娠早期FMO3的表达水平,结果显示,FMO3蛋白表达随妊娠进展呈渐进性上升,且FMO3主要表达于滋养层干细胞(DSCs)而非滋养层免疫细胞(DICs)(图A-C)。
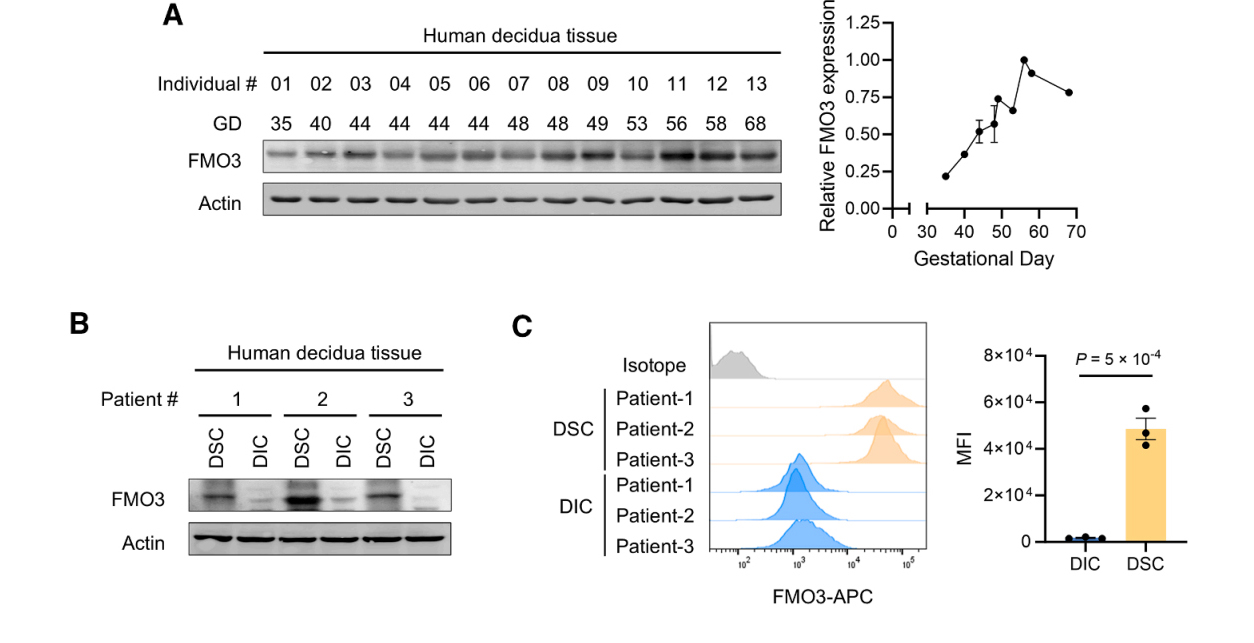
研究者利用HpESCs建立体外蜕化模型,评估了蜕化前后FMO3的表达水平。体外蜕化后,FMO3的蛋白和mRNA水平均显著升高(图D)。
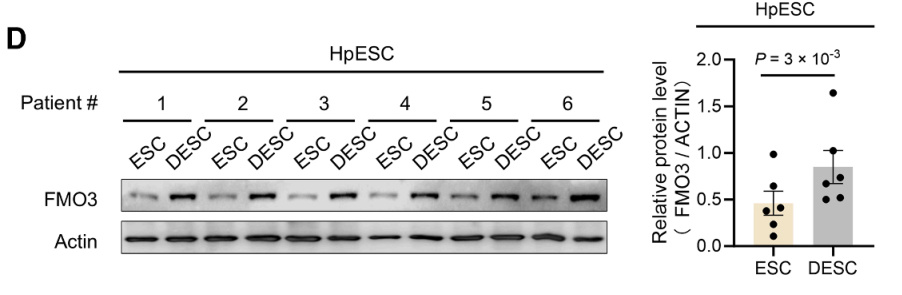
与小鼠模型相似,人类妊娠妇女的子宫内膜样本显示出显著高于非妊娠个体的TMAO水平,且随妊娠进展呈渐进性积累(图E-F)。并且复发性流产患者样本中FMO3的蛋白和mRNA(图G-I)水平均显著降低。
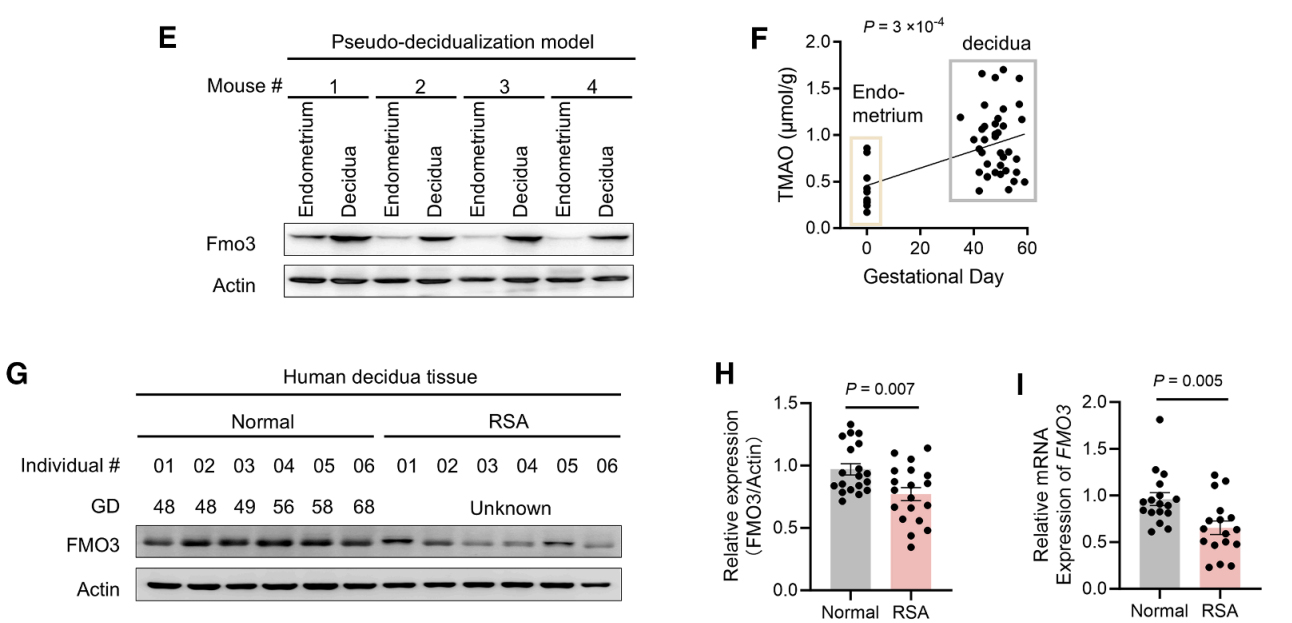
研究者构建了子宫特异性Fmo3特异性敲除(cKO)与特异性敲低小鼠。特异性敲除小鼠使用了Fmo3f/f; Pgrcre/+小鼠;特异性敲低小鼠使用在宫腔内注射AAV9-CMV-shFmo3。两种模型均表现出子宫TMAO水平显著降低,妊娠过程中显著增加胚胎吸收率、降低胚胎重量、吸收部位胎盘膜标志物下调等表型,表明胎盘膜化过程受损(图J-O)。
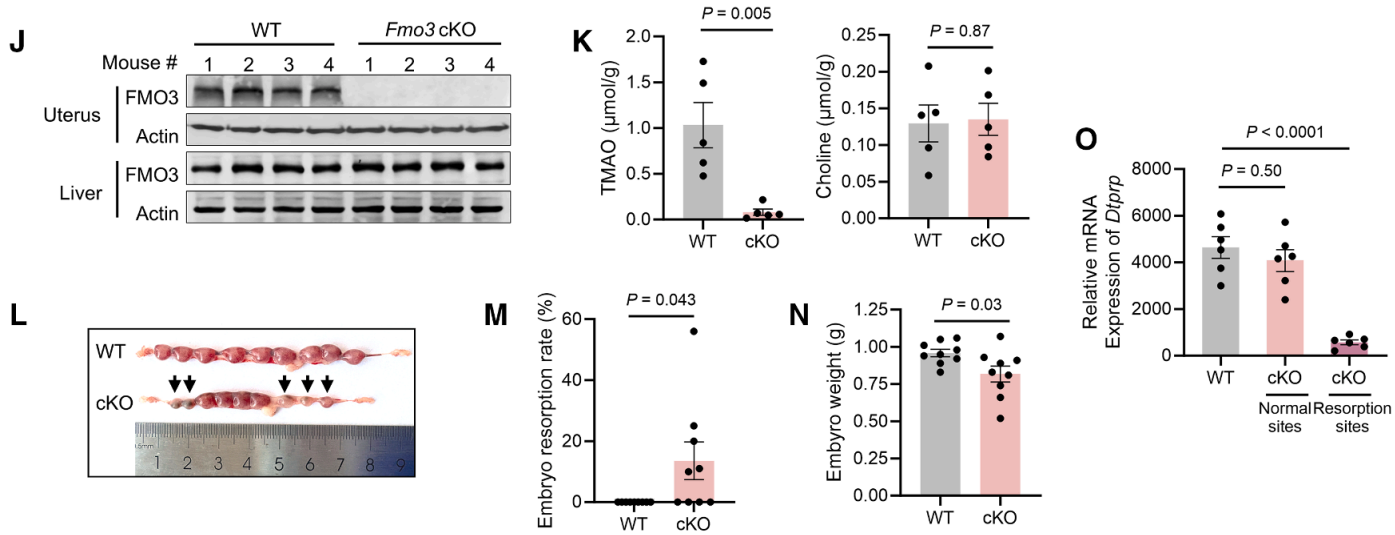
这些结果共同表明,胎盘FMO3对于维持局部TMAO浓度至关重要,而TMAO浓度反过来又支持胎盘基底膜微环境的稳态和妊娠的存活能力。
4
胎盘基底膜中FMO3的转录
依赖于PKA-CREB1通路
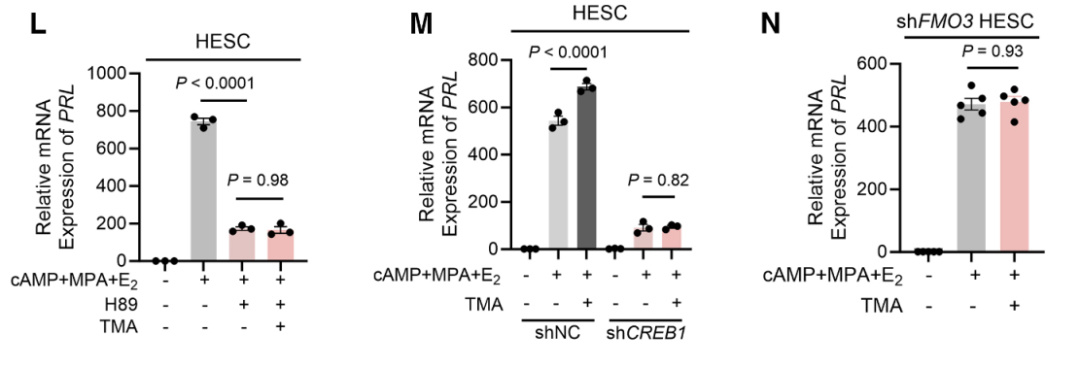
研究者进一步探究雌激素、8-溴环磷酸腺苷(cAMP)和醋酸甲羟孕酮(MPA)中哪一种激素主要调控FMO3的表达。在HpESCs体外模型中,cAMP显著诱导FMO3表达,而FMO1、FMO2、FMO4和FMO5的表达水平保持不变(图A和B)。
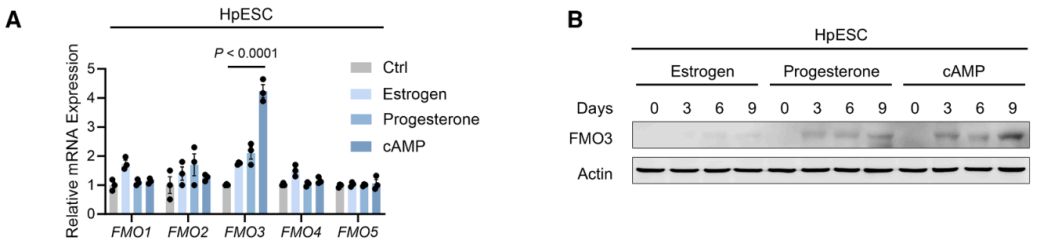
研究者进一步探究cAMP调控FMO3表达的具体机制,并利用数据库分析将目光集中在了PKA-CREB1通路上。PKA抑制剂H89可阻断8-溴-cAMP诱导的FMO3积累(图C-D)。敲低CREB1后,FMO3 mRNA和蛋白表达均显著下降(图E-F)。
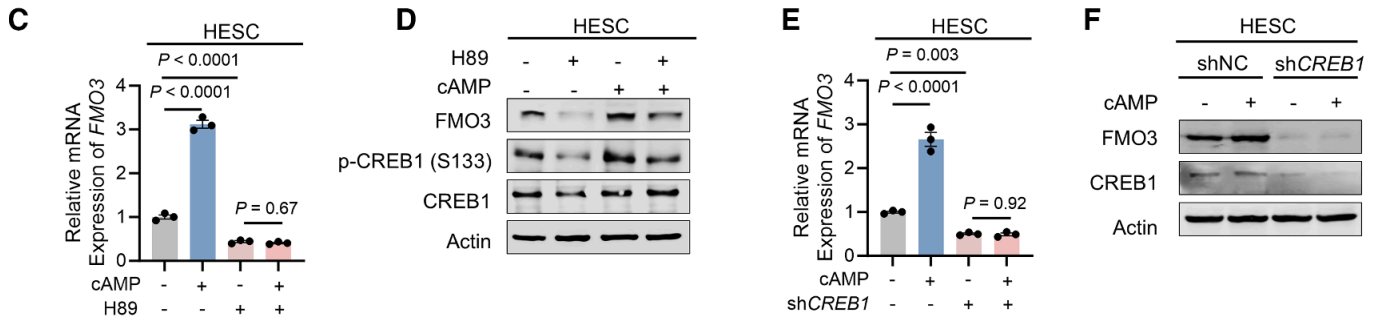
CREB1可结合FMO3启动子中−684至−672及+102至+114位点,而其中+102/+114位点影响CREB1的转录活性(图G-I)。此外,在复发性流产患者的胎盘组织中,经CREB1免疫沉淀的FMO3 +102/+114区域表达水平低于对照组,CREB1磷酸化水平降低(图J-K)。
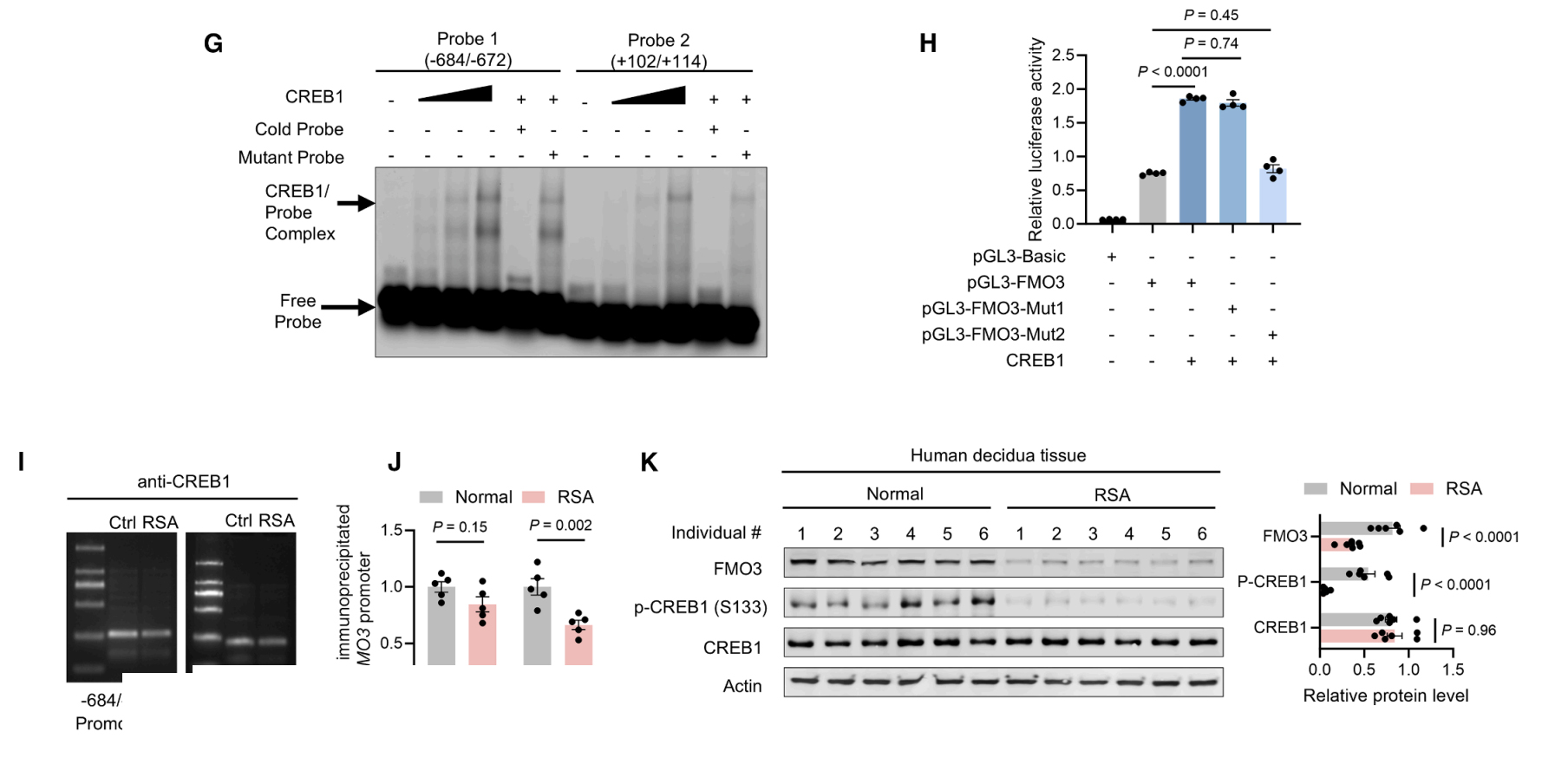
研究者通过使用H89抑制PKA或通过shRNA敲低CREB1或敲低FMO3均观察到TMA诱导的蜕膜化促进作用减弱(图L-N),这些综合结果有力证明:cAMP-CREB1信号通路在激活FMO3表达中发挥关键作用,而FMO3表达又正向调控胎盘形成过程。
5
TMAO促进FOXO1向细胞核的转位
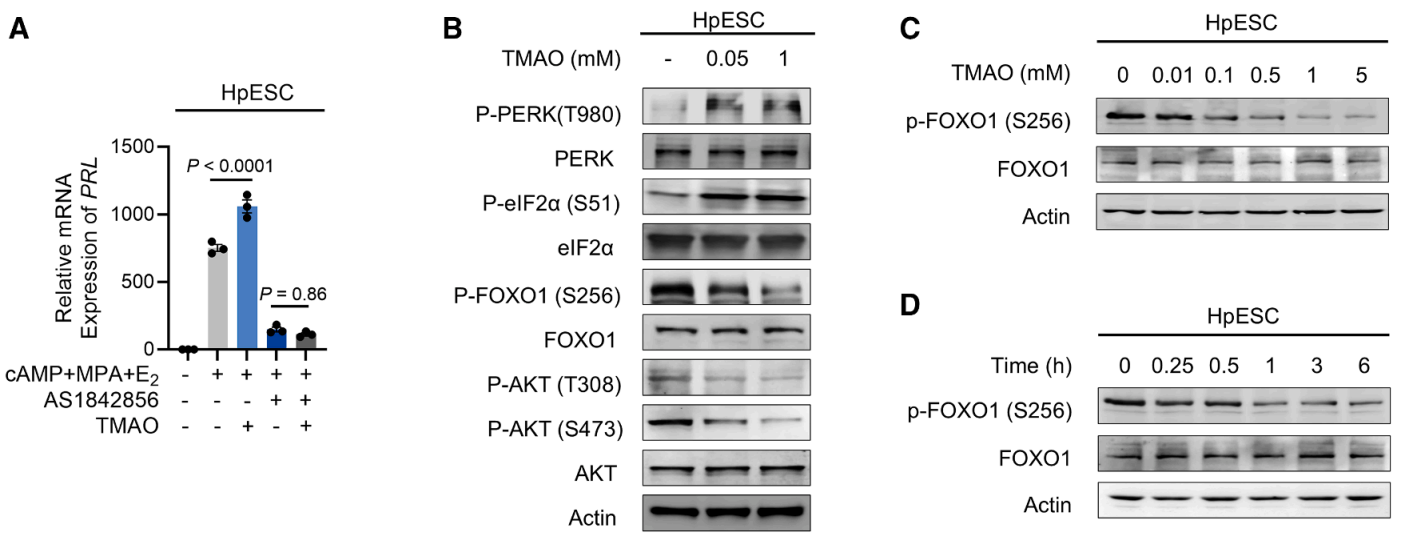
为确定TMAO促进蜕膜化的具体机制,研究人员首先证明其TMAO作用机制与渗透调节无关,而是通过激活PERK促进FOXO1表达。
在HpESCs体外模型中,FOXO1抑制剂AS1842856阻断了TMAO对蜕膜化作用的影响。而使用TMAO处理可抑制HpESCs中AKT的磷酸化,且TMAO在不同剂量(0.01-5 mM)和时间点(最长6小时)范围内均可影响FOXO1磷酸化水平,而未改变FOXO1的表达水平(图B-D)。这些发现表明,尽管TMAO可通过PERK依赖性积累和AKT依赖性去磷酸化双重途径调节FOXO1,但在胎盘基底膜中观察到的生理浓度下,AKT介导的机制可能占主导地位。
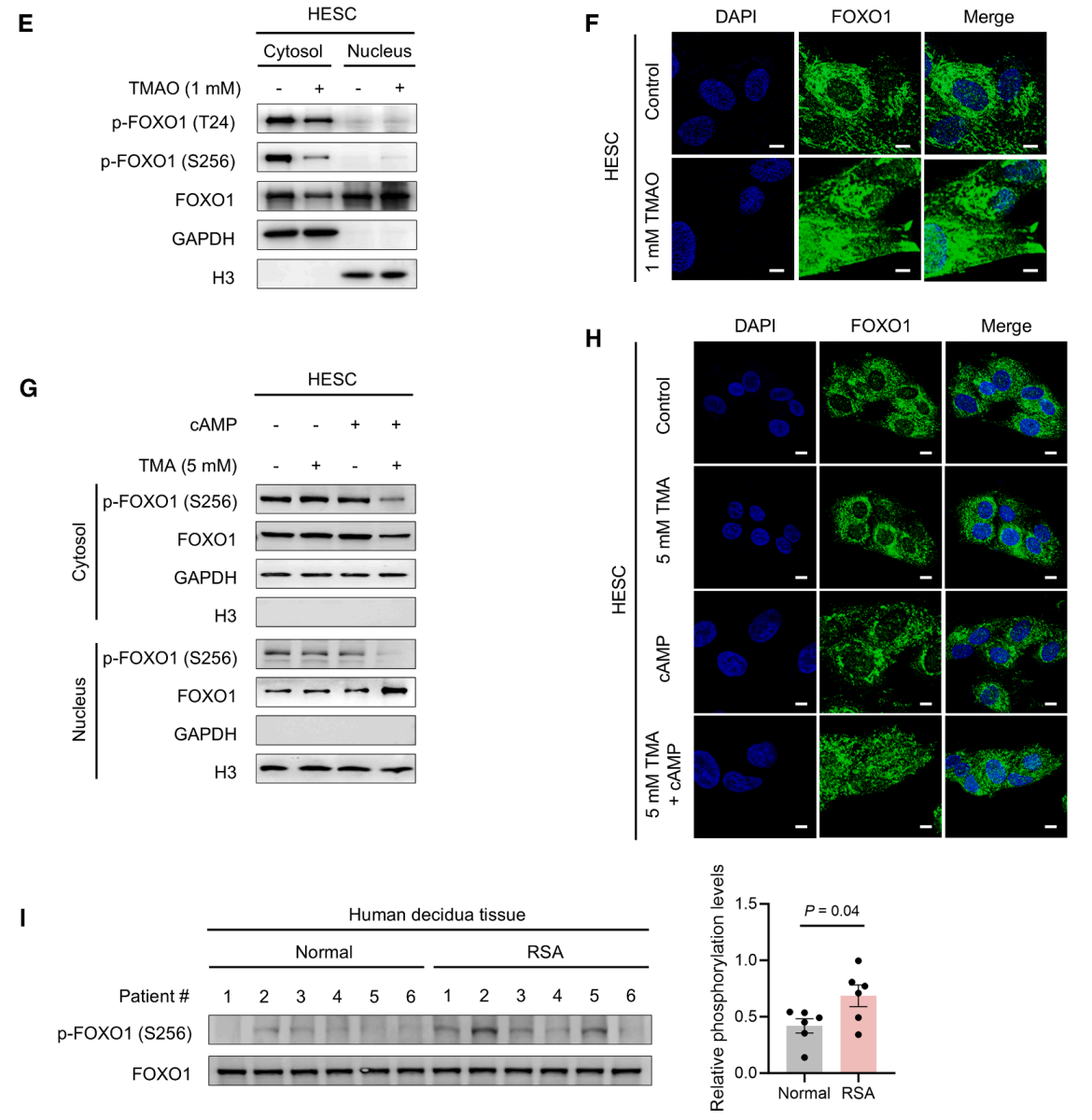
之后研究者分离并分析HESCs的核和胞质组分。结果发现,TMAO显著提高了核内FOXO1的表达水平,降低了胞质中磷酸化FOXO1的水平,促进了FOXO1向细胞核的转位(图E-F)。仅在cAMP存在时,TMAO才促进FOXO1在细胞核内的积累(图G-H)。对比复发性流产患者与对照组的胎盘组织,复发性流产患者体内磷酸化FOXO1水平显著升高(图I)。
6
TMAO与14-3-3η蛋白互作,增强14-3-3η与
PDK1的结合,从而提升FOXO1的转录活性
研究者进一步探究TMAO如何降低FOXO1的磷酸化水平并促进其核定位。通过有限蛋白水解-小分子映射技术(LiP-SMap)与药物亲和力响应靶标稳定性(DARTS)实验,研究者锁定了14-3-3η(由YWHAH基因编码)与TMAO呈现强相互作用,拥有显著增强的热稳定性(图A-D)。
为探究14-3-3η与TMAO的潜在相互作用位点,研究者进行分子对接模拟,并用突变体证实D214和D218是介导TMAO与14-3-3η特异性相互作用的关键残基(图B-E)。综合上述功能分析表明,TMAO可直接与14-3-3η结合。
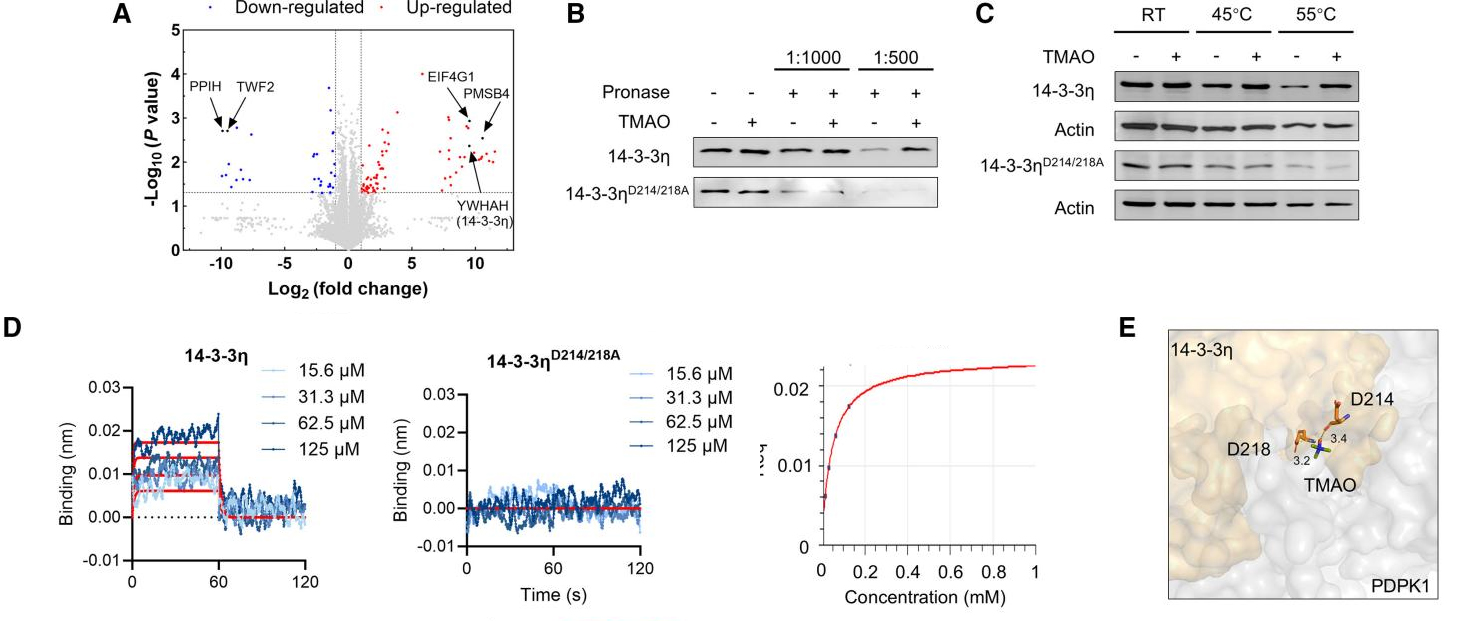
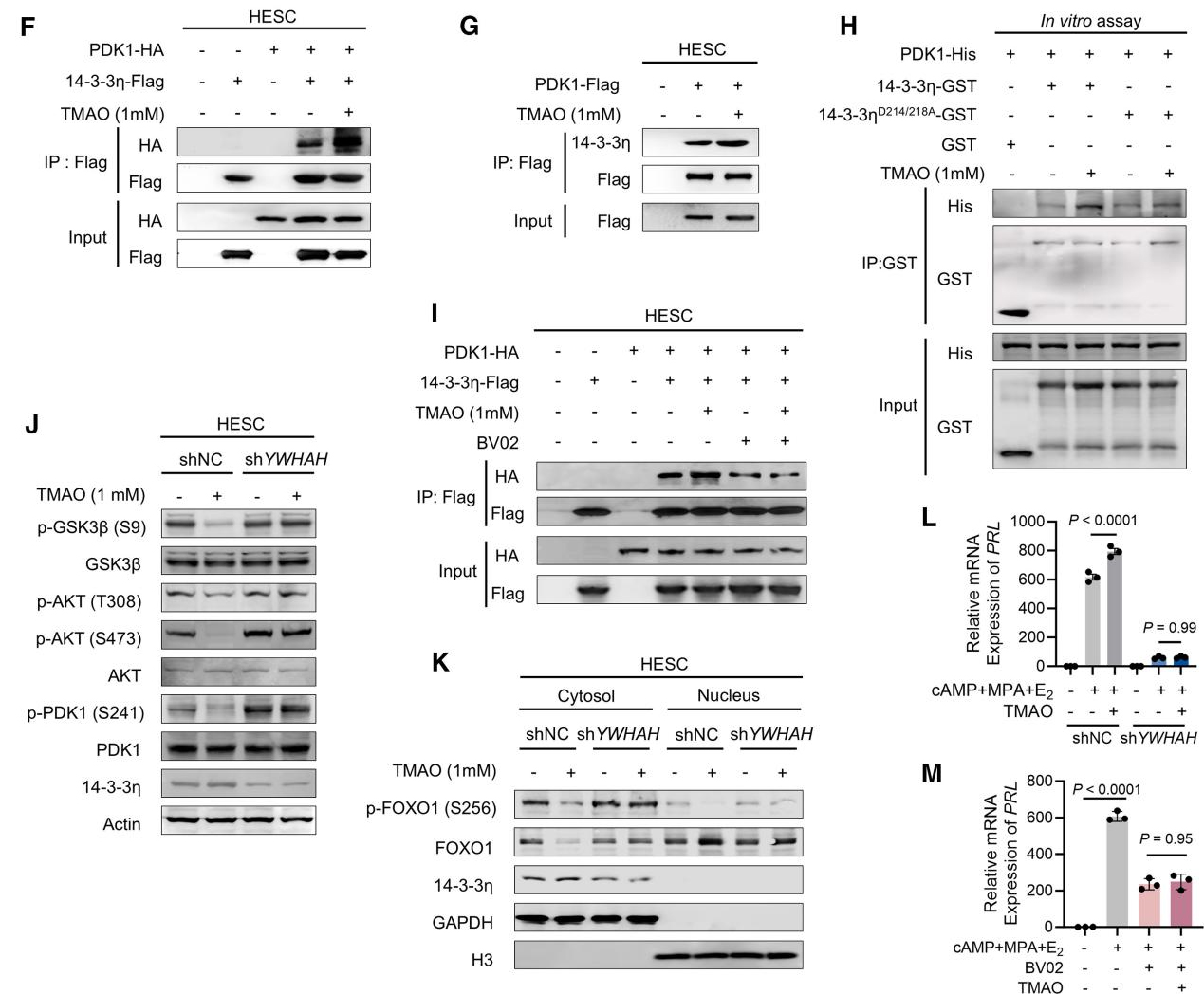
结构预测进一步揭示,TMAO结合位点位于14-3-3η与PDK1相互作用的界面(图E)。IP与GST沉淀实验证实,TMAO处理显著增强了14-3-3η-PDK1相互作用,且依赖于D214、D218位点(图F-H)。14-3-3η抑制剂BV02阻断了TMAO介导的结合增强作用(图I)。此外,TMAO抑制了PDK1-AKT通路和FOXO1核转位,而敲低14-3-3η可消除这种抑制作用(图J-K)。并且无论是敲低14-3-3η或是使用抑制剂BV02均会损害体外蜕膜化过程并激活AKT-FOXO1通路,导致该系统对TMAO的挽救作用无反应(图L-M)。
7
TMAO挽救了部分复发性流产患者
来源的HpESCs的蜕膜化过程
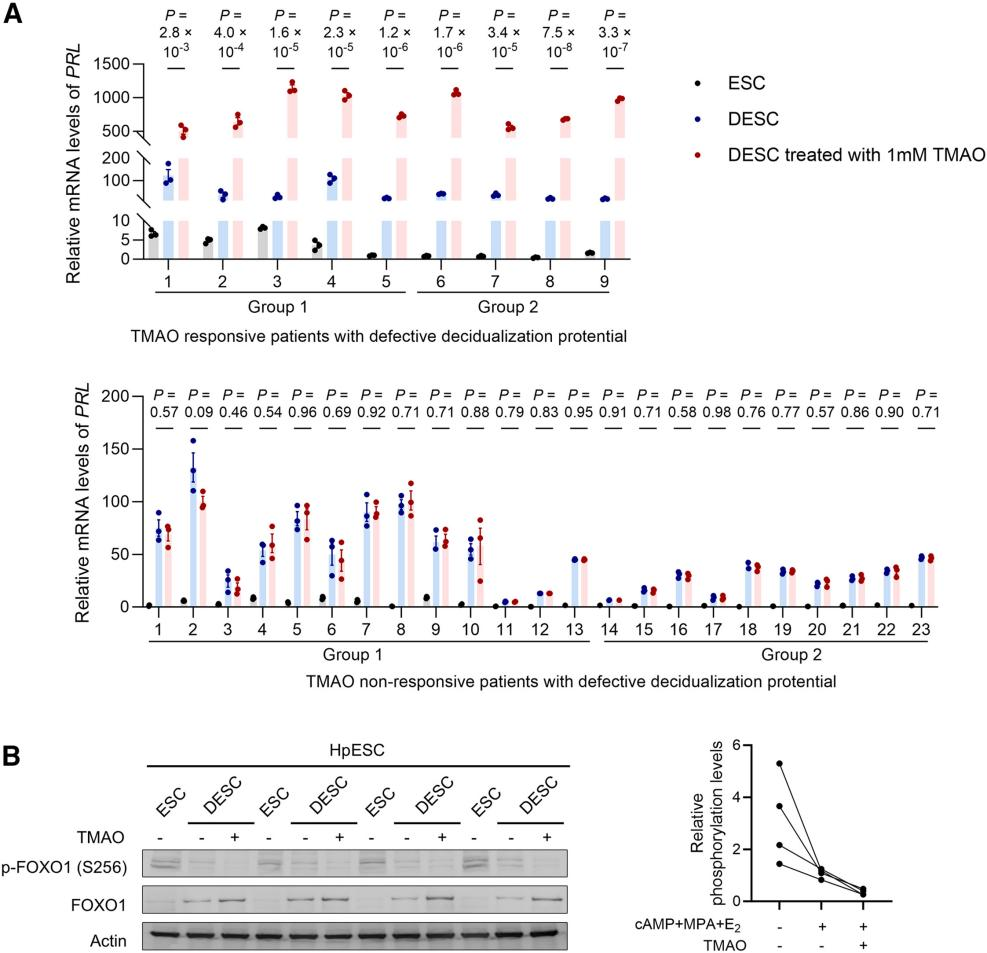
为评估TMAO在复发性流产中的治疗潜力,研究者收集了RSA患者的子宫内膜组织,并分离出HpESCs进行体外蜕膜化培养,以检测TMAO能否挽救蜕膜化过程。
在第1组34例患者HpESCs的蜕膜化实验中,18份HpESC样本在诱导过程无法实现正常蜕化。添加TMAO后,5份样本的蜕化能力获得挽救。在第2组26例患者HpESCs中,4份功能受损的样本在TMAO处理后实现了功能恢复(图A)。综合而言,TMAO使15%(9/60)患者来源的HpESCs恢复了蜕膜化能力。两个独立组别中一致的发现表明,TMAO可特异性挽救部分RSA患者的脱落膜化功能障碍。此外,在TMAO响应型患者中,经TMAO处理后观察到FOXO1蛋白积累及磷酸化FOXO1显著下调(图B)。综上,本研究为RSA患者和TMAO水平异常者提出了一种新的干预策略。
关于我们
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,简称"南模生物"),成立于2000年9月,是一家上交所科创板上市高科技生物公司(股票代码:688265),始终以编辑基因、解码生命为己任,专注于模式生物领域,打造了以基因修饰动物模型研发为核心,涵盖多物种模型构建、饲养繁育、表型分析、药物临床前评价等多个技术平台,致力于为全球高校、科研院所、制药企业等客户提供全方位、一体化的基因修饰动物模型产品解决方案。






